江大张荣珍教授团队:突破胆红素合成瓶颈,实现克级高效生物制造

【SynBioCon】获悉,近日,江南大学生物技术学院张荣珍教授团队联合中国科学院上海药物研究所、美国约翰斯·霍普金斯大学等机构,在《自然·通讯》(Nature Communications)上发表题为《Systemic engineering and global regulation enabling high-level bilirubin biosynthesis》的研究论文,成功构建了一个高效体外酶催化级联系统,将胆红素产量提升至1.7克/升,产率达95.8%,实现了该高价值化合物克级规模的生物合成,为工业化生产奠定了坚实基础。

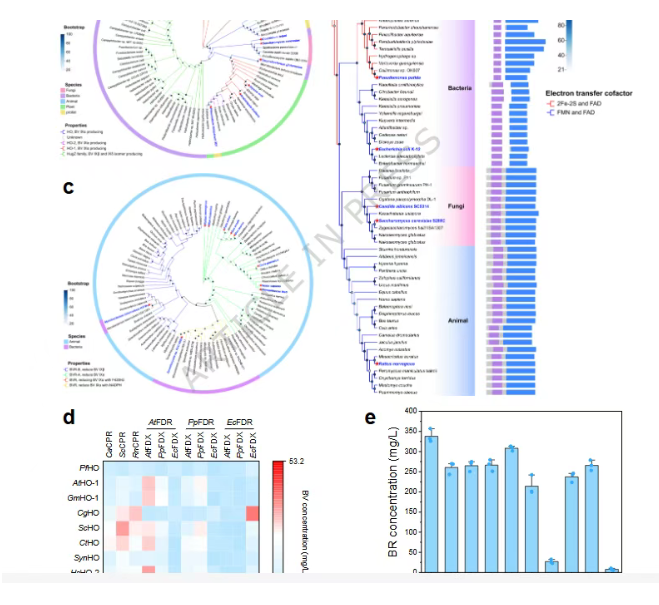
研究首先厘清了从血红素到胆红素的经典两酶催化路径,并通过对血红素加氧酶、其氧化还原伴侣蛋白以及胆绿素还原酶的系统进化分析和筛选,从众多物种中鉴定出了最高效的酶组合。实验表明,来自大鼠的HO-1与其专一的细胞色素P450氧化还原伴侣CPR的组合,在催化血红素转化为胆绿素这一步中效率最高;同样来自大鼠的BVR-A亚型则在后续将胆绿素还原为胆红素的步骤中表现最佳。
为进一步提升酶的可溶性表达,研究团队对筛选出的关键酶进行了结构分析。他们发现大鼠CPR蛋白的N端和大鼠HO-1蛋白的C端存在疏水性膜锚定区域。通过逐步截除这些区域,成功获得了可溶性大幅提高的截短变体RnCPRΔ54和RnHO-1Δ22。生化动力学分析证实,这些截短变体在保持与野生型酶相当的底物亲和力和催化效率的同时,解决了异源表达中的溶解度难题。
然而,在利用优化后的酶组合进行一锅法反应时,尽管血红素转化率可达83.9%,但胆红素的最终产率却停滞在48.1%,存在明显的物料损失。通过时间进程分析,研究人员将瓶颈锁定在血红素加氧酶催化的第一步反应中,并推测反应副产物——二价铁离子(Fe²⁺)和一氧化碳(CO)——可能对产物稳定性产生了负面影响。
为了验证这一猜想,团队深入探究了Fe²⁺的作用机制。实验发现,Fe²⁺能够与去质子化的胆绿素或胆红素结合,形成复合物。密度泛函理论计算表明,这种配位作用能够显著降低复合物的前线分子轨道能隙,尤其是在引入O₂等轴向配体后,使得复合物更易于发生单电子转移。由此,Fe²⁺不仅是一个被动的副产物,更成为激活氧分子、引发自由基链式反应、最终导致卟啉环氧化降解的主动驱动者。
基于对降解机制的深刻理解,研究人员开发了双管齐下的稳定策略。一方面,他们筛选了多种金属螯合剂,发现羟乙二膦酸(HEDP)能有效螯合Fe²⁺,将胆绿素和胆红素的产率分别提升约150%。另一方面,他们发现降低反应pH值可以抑制胆绿素/胆红素的去质子化,从而减弱其与Fe²⁺的配位能力。将HEDP螯合与温和酸化(pH 6.5)相结合,产生了协同效应,最大限度地抑制了Fe²⁺诱导的副反应,将胆红素产率提升至80.1%。
在解决了Fe²⁺的干扰后,研究揭示了另一个抑制因素——副产物一氧化碳(CO)。理论计算和分子动力学模拟表明,CO与游离血红素的结合力远强于O₂,形成的血红素-CO复合物虽然稳定,但其线性几何构型会在血红素加氧酶的活性口袋中产生空间位阻(关键残基Ser142处尤为明显),阻碍底物结合与O₂的激活,从而强烈抑制酶催化循环。实验证实,用CO预处理血红素会显著降低血红素加氧酶的活性。
为了彻底解除所有抑制因素,研究团队构建了一个完全集成的多酶系统。他们在原有核心酶(RnHO-1Δ22, RnCPRΔ54, RnBVR)的基础上,引入了两种辅助酶:一是工程化的一氧化碳脱氢酶(ChCODH),用于将抑制性的CO氧化为无毒的CO₂;二是甲酸脱氢酶(ApFDH),用于实现辅因子NADPH的原位再生,无需外部添加。
最终,这个包含五种酶的一体化级联反应系统在1升规模的反应中,成功将3 mM(1953 mg/L)的血红素完全转化为2.87 mM(1678.4 mg/L)的胆红素,产率高达95.8%。产物的化学结构经核磁共振谱确证为具有生物活性的胆红素IXα异构体。
欢迎投稿
本公众号长期开放投稿,助力生物制造领域科技成果化、产品商品化!
▌参考信息:本文部分素材来自公众号ScienceAI等。由作者重新编写,系作者个人观点,本平台发布仅为了传达一种不同观点,不代表对该观点赞同或支持。如果有任何问题,请联系我们:15356747796(微信同号)。




